Sokratische Methode des Fragens
Sokrates hat mit seiner Fragetechnik (Mäeutik) viele Menschen zum Schwitzen gebracht, denn er hat bei vordergründigen Antworten immer tiefer nachgefragt. Sein Ziel war es, sich damit der Wahrheit anzunähern. Karl Popper hat in seiner Erkenntnistheorie das Verfahren optimiert und als kritischen Rationalismus zusammengefasst. Liegt ein Problem vor, so sollte man vorurteilsfrei die Datenlage prüfen und wenn dort die Antwort nicht zu finden ist, möglichst breit Vermutungen bzw. Hypothesen aufstellen. Diese sollten dann mit allen zur Verfügung stehenden wissenschaftlichen Methoden abgearbeitet werden. Dabei beschleunigen falsifizierende Ansätze die Wahrheitsfindung oder besser die Annäherung an die Wahrheit deutlich.
In den etablierten Wissenschaftsdisziplinen gibt es leider immer weniger diesen oberbegrifflichen Ansatz. Durch partikulare Interessen werden Fragestellungen oft einseitig angegangen, sodass die Lösungen sich nicht selten immer weiter von der Wirklichkeit entfernen. Das manifestiert sich dann in Empfehlungen, Leit- und Richtlinien, die dann oft politische Auswirkungen in der Mittelverteilung oder auch in Rechtsnormen haben. Damit wird die Unwissenschaftlichkeit zementiert.
Die aktuellen wissenschaftlichen Publikationen
Schatten aus Wuhan - Die Bergamo-Apokalypse: Hypothesen zur Ursache und Lehren für zukünftige Pandemien
Das Sokratesforum hat sich mit Fragen rund um die etwa zehnfach erhöhte Letalität in Bergamo im März 2020 näher beschäftigt, nachdem die Zahlen vor kurzem bestätigt wurden. Ein Letalitätspeak trat gleichzeitig in nur wenigen anderen Regionen in Europa auf. Da wir uns seit Beginn der Pandemie mit den zahleichen publizierten wissenschaftlichen Daten beschäftigen, kommen wir nun zu einem Verständnis, das es erlaubt aus dem Bergamo Phänomen interessante Schlüsse für zukünftige Pandemien zu ziehen.
Forderung einer Enquete-Kommission zur systematischen Aufarbeitung der Pandemie
Es wird Zeit!
Warum wir endlich eine Enquetekommission des Bundestages zur Pandemiepolitik brauchen.
Lehren aus der Pandemie
Wegen der aktuellen Aufarbeitung der Coronapandemie möchten wir auf unser im Januar 2023 erstelltes Papier hinweisen, das schon damals alle wesentlichen Punkte behandelte. Wir haben es noch einmal durchgesehen, ob sich inzwischen relevante wissenschaftliche Erkenntnisse ergeben haben, die unsere Kernaussagen abändern. Das war nicht der Fall.
Das zunehmende Verschwinden der erkenntnistheoretischen Methoden aus der Wissenschaft – Ursache vieler politischer Probleme
Das Paper „Erkenntnistheoretische Grundlagen und ihre Beachtung in der heutigen Wissenschaft“ besteht aus drei Teilen:
Teil I: Erkenntnistheoretische Grundlagen
Teil II: Erkenntnistheoretische Problemstellen von Beobachtungsstudien
Teil III: Erkenntnistheoretische Problemstellen bei der Überprüfung von Hypothesen
Pressemitteilungen und öffentliche Beiträge
Acht Antworten auf acht Fragen: Herr Hamann recherchiere für ein Portal namens „Volksverpetzer“ über einen Artikel, der in der NZZ am 9. Dezember 2025 erschienen ist
Zum PDFAm 10. Januar diesen Jahres erreichte die Sokrates Gruppe um 21:28 Uhr eine Mail von Herrn Hamann. Er recherchiere für ein Portal namens „Volksverpetzer“ über diesen Artikel, der in der NZZ vom 9. Dezember 2025 erschienen ist.
Sokratesmitglied Gerd Antes als Sachverständiger in der Enquetekommission
Klarheit schaffen
In seinem Eingangsstatement als Sachverständiger in der Enquetekommission formuliert Gerd Antes die Voraussetzungen einer wissenschaftlich fundierten Aufarbeitung der politischen Maßnahmen in der Pandemie. Wir dokumentieren seine Stellungnahme zur Versachlichung einer bisher gescheiterten Debatte.
Grundsätzlich
Während der Pandemie und auch jetzt in der Aufarbeitung werden Grundprinzipien des methodischen Weges von Daten zu Wissen nicht angewendet und tauchen damit auch in der öffentlichen Debatte nicht auf. Das möchte ich in der verfügbaren Zeit kurz skizzieren und die daraus folgenden Konsequenzen formulieren.
Wir können die Wirksamkeit einzelner Maßnahmen nur dann beurteilen, wenn wir wissen, wie sich die Realität ohne diese Maßnahmen entwickelt hätte. Dieses kontrafaktische Denken – der Vergleich mit einem geeigneten Kontrollszenario – ist das Fundament jeder kausalen Bewertung. Ohne einen solchen Vergleich lassen sich Wirkungen nicht belegen, sondern nur behaupten.
In solchen Vergleichen müssen Maßnahmen grundsätzlich im Dreiklang von Nutzen, Schaden und Kosten bewerten werden. Es reicht nicht, allein auf verhinderte Infektionen oder Todesfälle zu schauen; wir müssen zugleich die unmittelbaren und mittelbaren Schäden (medizinisch, sozial, psychisch, wirtschaftlich) sowie die finanziellen und gesellschaftlichen Kosten systematisch erfassen. Dieses Grundprinzip der Technikfolgenabschätzung – im Gesundheitswesen als HTA (Health Technology Assessment) bezeichnet - wird seit ca. 1960 entwickelt und schafft einen klaren Rahmen für Bewertungen.
Selbst wenn dieser Überbau richtig berücksichtigt wird, gibt es eine Reihe von “handwerklichen“ Fehlern, die sich durch die gesamte Zeit zogen und zu massiven Verfälschungen und falschen “Wahrheiten“ führten und noch führen. Zu nennen sind hier in erster Linie:
1. Die massive und alle anderen Faktoren schlagende Abhängigkeit vom Alter verbietet es, Betrachtungen und Auswertungen ohne explizite Berücksichtigung vom Alter durchzuführen (sogenannte Stratifizierung). Relevant wird das unter anderem beim sogenannten Basis-Reproduktionsfaktor (kleiner, gleich, größer als 1). Daraus Maßnehmen für die ganze Bevölkerung abzuleiten, ist mehr als fehleranfällig.
2. Thema war und ist immer wieder “Datenmangel“. Ernst genommen wurde das jedoch nie, sondern Beschreibungen und Bewertungen wurden größtenteils dichotomisiert, d. h. auf 0/1 oder schwarz/weiss reduziert. Das bedeutet den vorsätzlichen Verzicht auf enorme Information und ist extrem fehleranfällig. Vor allem bedeutet es Verzicht auf Daten für die immer wieder geforderte Verhältnismäßigkeit, die ja u. a. für die Rechtsprechung fundamentale Bedeutung hat. . Es war allerdings talkshowgerecht, muss man sagen.
3. Gerade bei der Einschätzung und Bewertung von Maßnahmen behandelt man Faktoren, die extrem komplex voneinander abhängig sind und deshalb mit multivariaten Verfahren jeweils als einer von vielen betrachtet werden müssen. Faktoren einzeln zu betrachten ist fachlich falsch. Dadurch kann die Wirksamkeit einzelner Maßnahmen außerordentlich falsch eingeschätzt werden. Ein Beispiel dafür ist das Maßnahmenbündel eines Lockdowns und daraus einzeln eine nächtliche Ausgangsperre.
4. Empirisch ermittelte Aussagen müssen mit einer Einschätzung der Sicherheit/Unsicherheit der Aussagen versehen sein, bzw. das Vertrauen in eine Aussage gehört zur Aussage selbst. Eine der chronischen Schwächen: „We are unable to admit we simply don’t know bezeichnet diese Misere. Größtes Misstrauen ist angesagt bei Aussagen wie “der Lockdown hat 16000 Todesfälle verhindert“.
Das sind 4 wesentliche Beispiele, zu denen viele weitere genannt werden können. Das verbindende Element dabei ist die systematische Ignorierung von Wissenschaftsprinzipien, die seit langem etabliert sind und angewendet werden müssen.
Eine besonders unrühmliche Rolle spielt dabei das sogenannte „Präventionsparadoxon“.
Das Phänomen gibt es seit langer Zeit, in der Pandemie bot es sich allerdings geradezu an, damit solche kausalen Behauptungen zu belegen. Das Ausbleiben einer Katastrophe wurde als Beleg für die Wirksamkeit der Maßnahmen gedeutet und sinkende Krankenhauszahlen geradezu als Beweis für ihren Erfolg präsentiert. Damit wurde eine wissenschaftlich nicht haltbare Logik etabliert: Wenn die Zahlen steigen, war es die Pandemie; wenn sie fallen, war es die Maßnahme; und wenn sie niedrig bleiben, war der Erfolg nur nicht sichtbar. Aus epidemiologischer Sicht ist diese Argumentation unzulässig, weil sie den notwendigen Vergleich durch eine Behauptung ersetzt.
Erst wenn diese methodische Grundlagen ernst genommen werden, können belastbare Aussagen über Nutzen oder Schaden einzelner Interventionen getroffen werden.
Zu guter Letzt: Die Nichtnutzung 3er völlig unterschiedlicher Strukturen, in denen diese methodischen Prinzipien nicht ignoriert werden:
1. Die nationale Kohorte (NAKO). 200000 Teilnehmer, öffentlich finanziert, gegen Dunkelziffern das richtige Mittel, wurde nie genutzt.
2. Das Institut für Qualität und Wirtschaftlicheit im Gesundheitswesen (IQWiG). Methodisch wohl die geeignetste Institution in Deutschland). Kein Auftrag vom BMG, obwohl das BMG dazu gesetzlich befugt ist.
3. Der Pandemieplan beim RKI (Teil 1, 72 Seiten, Strukturen und Maßnahmen, Teil 2, Wissenschaftlich Grundlagen, 221 Seiten)
Es darf nicht darum gehen, nachträglich Narrative zu bestätigen, sondern anhand solider Kriterien zu prüfen, was tatsächlich gewirkt hat und was fälschlich als Wirkung dargestellt wurde. Nur mit dieser Klarheit wird die Kommission in der Lage sein, aus der Pandemie zu lernen, so dass zukünftige Entscheidungen besser gefällt und begründet werden können.
Hier der Link zur Sitzung: Vorsorge, Krisenpläne und Frühwarnsysteme
Interview aus dem Cicero mit Gerd Antes
Pandemien verstehen: Was Bergamos Todeszahlen für die Zukunft lehren
Beitrag in der Bayrischen Statszeitung, vom 16.12.2025
Sterbedaten aus Bergamo 2020 zeigten eine bis zu zehnfache Übersterblichkeit bei älteren Menschen. Eine neue Hypothese erklärt, warum die Sterberate ebenso schnell wieder abfiel – und plädiert für eine systematische Aufarbeitung
Stellungnahmen, wissenschaftliche
Beiträge und Videos
SARS-CoV2: Verbreitung via Aerosol
Anfang 2020 überfiel ein neues bis dato unbekanntes Virus, SARS-CoV2, die Welt und verbreitete sich rasant. Die ursprüngliche Wuhan-Variante zeichnete sich durch im Vergleich zu heutigen Varianten langsame Infektionsgeschwindigkeit aber eine große Aggressivität aus, die viele Menschenleben kostete. Mit jeder neuen Variante nahm die Infektiosität zu-, aber die Aggressivität ab. Damit hatte auch dieses Virus zumindest bis jetzt den typischen Weg für sein
Überleben eingeschlagen.
Autoren:
Dr. med. Thomas Hausen
Dr. Gerhard Scheuch
"Wir müssen aus den Fehlern lernen" - Gegen Corona impfen? Tests machen? Das hält Professor Dr. Dieter Köhler für unnötig
Zeitung für Schmallenberg vom 04.12.2024
von Katharina Kalejs
"Wir müssen aufhören, Angst davor zu haben, krank zu werden“, sagt Professor Dr. Dieter Köhler aus Winkhausen, Lungenfacharzt und ehemaliger ärztlicher Direktor des Fachkrankenhauses Kloster Grafschaft.
Titel Nach der Pandemie ist vor der Pandemie Frage
Lehren aus der COVID-19-Pandemie ziehen
Vor Kurzem haben Ärzte und Wissenschaftler unterschiedlicher Fachrichtun- gen ein Papier veröffentlicht, in dem sie die Maßnahmen während der COVID- 19-Pandemie aufgrund wissenschaftlicher Erkenntnisse bewerten. Dr. med. Thomas Hausen, Hausarzt und einer der Unterzeichner der Stellungnahme, fasst die wichtigsten Punkte im Gespräch mit dem Allgemeinarzt zusammen.
Verlorene Jahrzehnte – zurück zum paternalistischen Gesundheitssystem. Auswirkungen der Corona-Pandemie und des Epidemie-Managements auf die Gesundheitsversorgung Cicero Online, Teil 1-3
Zehn Thesen zur Aufarbeitung der Corona-Krise (Teil 1-3)
Im Zuge der Corona-Pandemie ist es zu den stärksten Freiheitseinschränkungen in Nicht-Kriegszeiten gekommen, während das deutsche Gesundheitssystem um Jahrzehnte zurückgeworfen wurde. Für Cicero formuliert Professor Matthias Schrappe, Internist und Gesundheitsökonom, zehn Thesen zur Aufarbeitung der Corona-Pandemie. Wir veröffentlichen sie in drei Folgen. Die erste lesen Sie hier.
VON MATTHIAS SCHRAPPE am 30. November 2022
Mehr erfahren: PDF: Download
Veröffentlichte Bücher

So erreichen Sie uns
Sie können die Beiträge, unter Einhaltung rechtlicher, urheberrechtlicher und ethischer Regeln, gerne kommentieren oder selber Beiträge erstellen. Lesen Sie dazu unsere Richtlinien.
Beiträge und Kommentare senden Sie bitte an die folgende E-Mail: info@sokrates-ev.de oder nutzen Sie das Kontaktformular.
Aktuelle wissenschaftliche Publikation
Schatten aus Wuhan
Das Sokratesforum hat sich mit Fragen rund um die etwa zehnfach erhöhte Letalität in Bergamo im März 2020 näher beschäftigt, nachdem die Zahlen vor kurzem bestätigt wurden. Ein Letalitätspeak trat gleichzeitig in nur wenigen anderen Regionen in Europa auf. Da wir uns seit Beginn der Pandemie mit den zahleichen publizierten wissenschaftlichen Daten beschäftigen, kommen wir nun zu einem Verständnis, das es erlaubt aus dem Bergamo Phänomen interessante Schlüsse für zukünftige Pandemien zu ziehen.
Das Phänomen nur vereinzelt auftretender Letalitätspeaks in der Pandemie ist erklärbar, wenn die seit über 10 Jahren bekannten Forschungsergebnisse der Ausbreitung von respiratorischen Pandemieviren und der Entwicklung einer Immunität berücksichtigt werden. Die Infektion erfolgt praktisch nur durch Abatmung und Einatmung der Viren. Manche Menschen, die selbst nicht oder nur gering erkranken und sich daher nicht selbst isolieren, atmen große Mengen von Viren ab (Superspreader). In geschlossenen Räumen mit schlechter Lüftung kann es dann zur Inhalation hoher Viruskonzentrationen kommen, so dass unser Immunsystem nicht genügend Zeit hat, ausreichend spezifisch und quantitativ zu reagieren. Im Verlauf entwickelt sich aber dann doch durch die ungebremste Ausbreitung des Virus und die vielen Kontakte mit dem Virus rasch eine zunächst clusterförmige und sich später weiter ausbreitende Immunität.
Hat das Virus eine stark krankmachende Potenz (Virulenz), wie das SARS-CoV-2 aus Wuhan, ist die Letalität bei Erstkontakten in einer Gruppe von sogenannten vulnerablen Personen (bei diesem Virus vor allem ältere Menschen) hoch. Im Verlauf entwickelt sich nicht nur eine immer breitere und stabilere Immunität in allen Gruppen der Bevölkerung, auch das Virus verliert durch immer weitere Mutationen an Virulenz.
Die Bergamo-Apokalypse: Hypothesen zur Ursache und Lehren für zukünftige Pandemien
Beitrag vom 26. September 2025
Autoren
Prof. Dr. med. Dieter Köhler (ehemaliger Direktor, Klinikum Kloster Grafschaft, Schmallenberg)
Dr. med. Thomas Voshaar (Vorsitzender des Verbandes Pneumologischer Kliniken e.V.; ehem. Chefarzt, Lungen- und Thoraxzentrum Moers)
Dr. phil. nat. Gerhard Scheuch (Physiker mit Schwerpunkt Aerosolmedizin
Priv. Doz. Dr. Andreas Edmüller (Philosophie, LMU München)
Prof. Dr. med Dominic Dellweg (Direktorder Klinik für Innere Medizin, Pneumologie und Gastroenterologie, Pius-Hospital Oldenburg)
Dr. med. Peter Haidl (ehem. Direktor, Krankenhaus Kloster Grafschaft, Schmallenberg)
Prof. Dr. rer. nat. Gerd Antes (Mathematiker und Medizinstatistiker, Universität Freiburg)
Dr. phil. Andreas F. Rothenberger, Fürstenfeldbruck (Philosoph und Unternehmer)
Dr. med. Thomas Hausen (Hausarzt im Ruhestand)
Norbert Paland (Ministerialdirigent a. D.)
Zusammenfassung
Neue Daten-Analysen zeigen, dass die Pandemie anders verlaufen ist, als bisher gedacht. Dies gilt vor allem für die Sterblichkeit. Die bedrohlichen Bilder aus Bergamo und die Berichte über sehr viele Todesfälle in kurzer Zeit schienen bisher einmalig. Ab der 12. Kalenderwoche 2020 verzehnfachte sich dort die Sterblichkeit für wenige Wochen im Vergleich zum langjährigen Mittel. In anderen Regionen wie der Lombardei, der Emilia Romagna, in Madrid, Stockholm, Paris und im Elsass kam es zu einem ähnlichen Phänomen mit hohen Sterbezahlen in kurzen Zeiträumen, sogenannten Letalitäts-Peaks.
Über die apokalyptischen Bilder aus Bergamo wurde viel diskutiert und letztendlich auch in Frage gestellt, ob tatsächlich so viele Menschen ihr Leben verloren, wie die Bilder nahegelegt haben. Vor Ort erhobene Friedhofsdaten bestätigen jetzt, dass diese Sterblichkeitsspitze real war. Hauptsächlich betroffen waren hochbetagte Menschen mit einem mittleren Alter von 83 Jahren.
Erstaunlicherweise ereigneten sich diese Peaks in den genannten Regionen in Europa etwa zeitgleich wie in Bergamo. In vielen andere Regionen ließen sich in einer aktuellen, retrospektiven Analyse jedoch keine erhöhten Sterbezahlen feststellen. Dies lässt den Verlauf der Pandemie hinsichtlich der Sterbefälle durch eine Infektion mit dem SARS-CoV-2-Virus in einem gänzlich neuen Licht erscheinen und wirft viele Fragen auf.
Erklärungsbedürftig sind mehrere Phänomene. Zum einen muss die hohe Letalität diskutiert werden, zum anderen ihr steiler Anstieg und ebenso steiler Abfall. Und dann bleibt noch die Frage nach der Ursache für die etwa zeitgleichen Peaks in nur wenigen Regionen Europas. Unsere Hypothese zur Erklärung einer nahezu synchron in wenigen Regionen und nur für wenige Wochen anhaltenden deutlichen Übersterblichkeit in der Corona-Pandemie berücksichtigt die rasche Ausbildung einer regionalen Immunität gegenüber dem zirkulierenden Virus-Typ ebenso, wie die für eine sehr rasche Ausbreitung erforderliche Ausbreitung via infektiöser, abgeatmeter virushaltiger Aerosole aus den Atemwegen und die Mutationen des Virus in Richtung geringerer Virulenz.
In den beschriebenen Clustern (Orten mit dem „Bergamo-Phänomen“) zirkulierte die ursprüngliche, hochgefährliche Ausgangsvariante (auch Wildtyp genannt) aus Wuhan, bevor sie sich durch Mutationen abschwächte. Die ursprüngliche Variante von SARS-CoV-2 besitzt genetische Merkmale, die eine Verbreitung fördern und die Gefährlichkeit im Vergleich zu den bisher eher harmlosen Coronaviren erhöhen.
Durch Abatmung der Viren, insbesondere durch Superspreader (Menschen, die besonders viele Viren abatmen), kommt es in geschlossenen Räumen zur raschen Verbreitung der Infektion. Die abgeatmeten Viren haben eine Partikelgröße von ca. 0,3µm, ähnlich Zigarettenrauch. Daher inhalieren alle Personen im Raum in kurzer Zeit Viren. Halten sich die Menschen länger im Raum auf, so inhalieren sie ggf. hohe Dosen, sodass unser Immunsystem nicht ausreichend Zeit hat, adäquat zu reagieren. Das erhöht dann die Letalität deutlich.
Der plötzliche Abfall der Sterblichkeit in Bergamo und anderen Hotspots lässt sich dadurch erklären, dass sich in den betroffenen Clustern innerhalb weniger Wochen eine lokale Herdenimmunität gegen den Wildtyp bildete. Danach dominierten zunehmend veränderte Virusvarianten mit geringerer Virulenz und damit reduzierter Letalität. Die markanten Übersterblichkeitsspitzen blieben im weiteren Pandemieverlauf aus, auch wenn es später noch Wellen gab.
Unterstützt werden unsere Annahmen durch die Statistik: Die außergewöhnlichen Peaks traten nur ganz zu Beginn auf und blieben einmalig. Regionale Faktoren, wie dichte Innenraumveranstaltungen und ein früher Kontakt zu chinesischen Arbeitsmigranten könnten zusätzlich zur raschen Verbreitung beigetragen haben.
Das Bergamo-Phänomen steht letztlich für wenige kurzzeitige Peaks der Sterblichkeit in Europa durch das Wuhan-Virus, das bestimmte Cluster mit einer hohen Virusdichte infiziert hat. Der weitere Verlauf der Pandemie vor der Impfung wurde vor allem von einer zunehmenden Immunität (insbesondere Schleimhaut-Immunität) und den Mutationen des Virus bestimmt.
Wie sieht die Datenlage aus?
Bereits im Januar 2020 gab es mehrere Berichte aus Wuhan, dass dort ein neues Virus aufgetaucht sei. Es wurden massive Gegen- und Schutzmaßnahmen eingeführt (1) sowie ein Containerkrankenhaus gebaut (2 ). Sogar von Menschen, die tot auf den Straßen lagen, wurde berichtet (3). Experten äußerten sich im Januar 2020 in Europa in den Medien dahingehend, dass es vermutlich ein regionales Problem und das Virus nach Angaben der WHO nur wenig infektiös sei (4).
Bald tauchten aber Berichte aus Wuhan und später New York auf, dass in den Krankenhäusern die Mortalität bei einer Infektion mit diesem Virus sehr hoch sei. Auch wurde früh von ausgedehnten Pneumonien mit eindrucksvollen Verdichtungen im Röntgenbild berichtet (5).
Dann erschreckten im März 2020 Meldungen und Bilder aus Bergamo die Welt. Die später immer wieder gezeigten Militärlastwagen mit Särgen haben diesen Eindruck verstärkt und verfestigt. Der Letalitäts-Peak in der Region Bergamo (ca. 1,1 Mio. Einwohner) hatte erhebliche politische Auswirkungen und ist als Kategorie „wöchentliche Todesfälle“ in Abb. 1 dargestellt (6). Etwa in der 12. Kalenderwoche 2020 kam es im Bezirk Bergamo zu einer plötzlichen Verzehnfachung der Letalität im Vergleich zum Wochendurchschnitt der Vorjahre. Die erhöhte Letalität war für ca. 3-4 Wochen zu beobachten, danach verschwand sie wieder.

Abb. 1: Verlauf der wöchentlichen Letalität im Bezirk Bergamo (Provinz Lombardei). Der Peak liegt in der 12. Kalenderwoche.
Gab es den Peak in Bergamo tatsächlich - und wer war betroffen?
Viele Epidemiologen hielten diesen Peak für einen unerklärlichen Ausreißer, denn ein solches Phänomen wurde bisher scheinbar noch nicht beobachtet. So etwas schien auch in der Coronapandemie nur im Bezirk Bergamo aufgetreten zu sein.
Es gab verschiedene Spekulationen über die Ursache der Todesfälle: Von Panikreaktionen in Altenheimen, bei denen das Personal diese fluchtartig aus Angst vor Ansteckung verlassen habe, sodass viele Patienten verdurstet oder durch andere Ursachen mangelnder Versorgung gestorben seien, bis hin zu einer systematischen Überforderung der Gesundheitsdienste, auch in den Krankenhäusern. Als Ursachen der Militärtransporte von Särgen wurden eine Überforderung der Krematorien und die Kapazität von Leichenhallen genannt. Letztlich kamen auch Zweifel auf, ob zu dieser Zeit in Bergamo tatsächlich so viele Menschen an dem neuen Corona-Virus gestorben wären, oder ob andere Erklärungen wie Vergiftungen oder falsche Therapien zutreffen könnten. Es wurde auch über einen statistischen Fehler spekuliert.
Zur Klärung der Hintergründe hat sich deswegen eine Gruppe um den Datenanalysten Tom Lausen im April 2025 nach Bergamo aufgemacht, um die Ursachen vor Ort zu ergründen. Dabei haben sie 27 Friedhöfe der Region besucht und die Verstorbenen nach Todesdatum gezählt (6). Es zeigte sich, dass der plötzliche Anstieg der Letalität mit raschem Abfall den Tatsachen entsprach: die vielen Toten gab es tatsächlich. Abb. 2 zeigt die Ergebnisse. Es handelt sich um die Daten von 17% der Friedhöfe, die mit den Daten von EUROSTAT verglichen wurden. Zur Sicherheit wurden zusätzlich in einer Stichprobe von 2017 und 2024 die Sterbefälle mit EUROSTAT verglichen. Sie stimmten ebenfalls überein.

Abb. 2: Vergleich der gefundenen Sterbefälle bei den Friedhofsbesuchen im Bezirk Bergamo mit den EUROSTAT Daten. Diese Abbildung wurde freundlicherweise von Tom Lausen zur Verfügung gestellt.
Hauptsächlich waren sehr alte Menschen betroffen. Das mittlere Sterbealter der auf den Friedhöfen erfassten Menschen lag bei 83,6, der Median bei 84,6 Jahren und damit etwas höher als der Durchschnitt in Italien mit 82,2 Jahren.
Gab es so einen Peak nur in Bergamo?
Mit diesem Hintergrundwissen hat Tom Lausen die europäischen Datenbanken nach regionalen Häufungen durchsucht. Überraschenderweise fand er ähnliche Peaks - wenn auch nicht so hoch wie in Bergamo - im gleichen Zeitraum der 10. bis 15. Kalenderwoche 2020 in einigen Städten wie Madrid, Paris, Stockholm aber auch in ländlichen Regionen wie im Elsass, auszugsweise dargestellt in Abb. 3 (6).
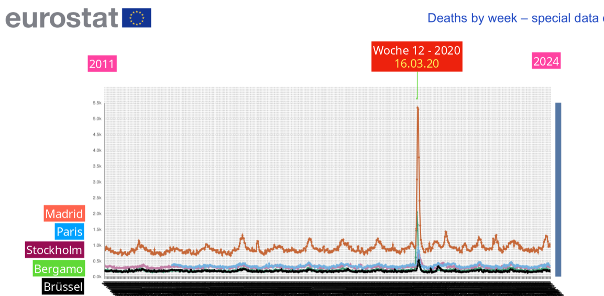
Abb. 3: Verlauf der wöchentlichen Letalität in verschiedenen Städten
Eine weitere systematische Analyse von Tom Lausen zeigt für ganz Europa ähnliche Hot Spots; bevorzugt in den Regionen, in denen chinesische Arbeitsmigranten in Fabriken, häufig in der Textilindustrie, tätig waren.
In den meisten anderen Städten oder ländlichen Regionen in Europa gab es jedoch keine vergleichbaren Peaks; Abb. 4 zeigt das z.B. für Rom (6).

Abb. 4: Fehlender Anstieg der Letalität in vielen Städten, hier Rom als Beispiel.
Diese neuen Beobachtungen und Fakten werfen klärungsbedürftige Fragen zur Pandemie auf. Im Folgenden werden wir im Sinne von Karl Popper (7) Hypothesen zur Entstehung dieses Phänomens aufstellen, wobei wir versuchen wollen, möglichst alle diskutierten Hypothesen zu diskutieren. Diese Hypothesen sollten auch viele der zum Teil widersprüchlichen Handlungen und Stellungnahmen in Politik und Wissenschaft zu Beginn der Pandemie erklären.
Wie sah es zu Beginn der Pandemie aus?
Ganz sicher war die Coronapandemie anfangs ein sehr ernstes Problem. Viele Patienten hatten tatsächlich eine schwere, ausgedehnte Pneumonie. Nach der ersten Märzwoche 2020 sahen auch vier unserer Mitglieder im Sokrates-Forum solche Fälle in ihren Krankenhäusern in Schmallenberg-Grafschaft und Moers (Dellweg, Haidl, Stais, Voshaar). Vergleichbar schwere Verläufe kommen bei den jährlichen Grippeepidemien recht selten vor. Ähnliche Krankheitsbilder, wenn auch weniger häufig, wurden in den selben Krankenhäusern während der Vogelgrippe 2006 beobachtet, wobei hier der Altersschwerpunkt um die 30 bis 40 Jahre lag (8). Die deutliche Häufung ungewöhnlich schwerer Fälle zu Beginn der Pandemie, etwa von März bis Juni, war also für alle neu.
Der Anstieg der Todesfälle, also die Übersterblichkeit, ging nicht mit einer direkt nachfolgenden Untersterblichkeit einher. Damit dürfte der zu erklärende Peak auch kein sogenannter „Harvesting Effekt“ sein. Mit diesem Begriff wird eine vorgezogene Übersterblichkeit in einer Gruppe von Personen bezeichnet, die sonst aufgrund ihrer schweren Erkrankung in den nächsten Tagen oder Wochen verstorben wären. Solche Effekte sind insbesondere für Hitzeperioden erfasst (9).
In den letzten Jahren haben sich die Hinweise verdichtet, dass das Coronavirus SARS-CoV-2 aus einem Labor in Wuhan entwichen ist (10 – 13). Tatsächlich wird in Wuhan seit Jahren Gain-of-Function-Forschung betrieben, u.a. um die Virulenz bzw. die Gefährlichkeit von Viren zu erhöhen und um deren pandemisches Potential zu erkunden (14, 15). Für eine solche Forschung mit gezielten Veränderungen am Genom von Viren eignen sich Corona-Viren offenbar besonders gut. Für unsere Hypothesen zur Ursache der Letalitätsspitzen in der Region Bergamo und in anderen Teilen Europas spielt der Ursprung des SARS-CoV-2 jedoch keine Rolle, da es vergleichbare Peaks auch aus historischen Berichten anderer Pandemien gibt. Andererseits können wir nicht ausschließen, dass das Wuhan-Virus gerade wegen einer möglichen genetischen Manipulation von Beginn an eine besondere Mutagenität hatte. Wir wissen ebenfalls nicht, ob Lungeninfektionen durch diesen Virus-Typ zu mehr Superspreadern führen, die für eine sehr rasche Ausbreitung und Cluster-Bildung besonders bedeutsam sind. Jedenfalls sollten diese Hypothesen in zukünftigen Pandemien besonders beforscht werden.
Coronaviren sind schon immer omnipräsent gewesen. Bei uns sind sie verantwortlich für einen großen Teil der jährlich wiederkehrenden Erkältungskrankheiten mit meist mildem Verlauf (16). Beim SARS-CoV-2-Virus ist durch die neuartige Furin-Spaltstelle im Spikeprotein des SARS-CoV-2 aus Sicht des menschlichen Immunsystems quasi ein neuer Virustyp mit neuer hochaffiner Andockstelle an die ACE-Rezeptoren im Menschen entstanden (17, 18).
Realistische Erkrankungs- und Letalitätsdaten aus Wuhan zu bekommen war und ist schwierig. Immerhin gibt es vom 28. Januar 2020 Informationen der chinesischen Gesundheitsbehörde, die von 4515 bestätigten Infektionsfällen in Wuhan spricht, wobei 106 Patienten verstorben seien (19). Es waren fast nur alte Menschen betroffen. Das wäre eine fallbezogene Todesrate (CFR) von 2,35%. Andere Presseberichte zeigen ähnliche Zahlen aus Wuhan und Umgebung, wobei die Todesraten teilweise noch höher waren. Geht man davon aus, dass etwa ein Fünftel dieser Infektionsfälle über 70 Jahre alt waren, so läge in dieser Altersgruppe die CFR etwa bei 12%.
Man kann also plausiblerweise davon ausgehen, dass die Letalität des neuen Virus aus Wuhan hoch war und anfangs in Wuhan mindestens bei 2-3% der als infiziert Gemeldeten lag. Das entspricht etwa der Spanischen Grippe der Jahre 1918/19, wobei diese aber vorwiegend Menschen jungen und mittleren Alters betraf (20, 21).
Was sollte man über Viren und deren Ausbreitung wissen?
Aus der Pandemieforschung ist bekannt, dass einige gefährliche Viren mit hoher Virulenz (krankmachende Wirkung) und hoher Infektiosität (Anzahl von Viren, um eine Erkrankung auszulösen) ihre Gefährlichkeit durch Mutationen im Verlauf abbauen. Insbesondere bei Atemwegsviren scheint dies der Fall zu sein. Die umgekehrte Entwicklung hin zu einer erhöhten Virulenz ist bei Atemwegsviren ungleich seltener. Der Grund: Je letaler ein Virus ist, desto eingeschränkter ist die Vermehrung, was einen evolutionären Nachteil für das Virus bedeuten würde. Die Zahl der neutralen Mutationen oder solcher, die bereits früher schon einmal auftraten und damit bereits im Immungedächtnis der Menschen gespeichert sind, ist auf jeden Fall ungleich höher.
Natürlich können die im Verlauf mutierten aber teilweise immer noch gefährlichen Viren erneut eine Epidemie mit relevanter Letalität auslösen, wenn sie auf eine bisher kaum infizierte Population treffen. Das war mit der Alpha-Variante in Ostdeutschland zum Jahresende 2020 passiert.
Von besonderer Bedeutung für den Verlauf einer Pandemie ist die Tatsache, dass die Dynamik der Mutationen auch von der Zahl der infizierten Wirte abhängt. Denn nur wenn sich Viren vermehren, können sie mutieren. Und zur Vermehrung benötigen sie einen Wirt - je mehr, desto besser. Schon bei der Infektion einer einzelnen Person entstehen im Laufe der Erkrankung aufgrund der sehr hohen Zahl an Virusreplikationen immer mehrere neue Varianten. Allerdings ist die Zahl der relevanten Mutationen (sog. „variants of concern“), die quasi zu neuen Viren und Krankheitsbildern führen, wesentlich geringer als die Gesamtzahl aller Mutationen. Impfungen oder Virostatika beeinflussen die Mutationen ebenfalls. In beiden Fällen können sich nur solche Viren vermehren, die gegen den Impfstoff bzw. das Medikament resistent sind. Dafür spricht z.B. die Beobachtung, dass bei mehrfach Geimpften tendenziell vermehrte Infektionen mit neuen Krankheitsbildern im Vergleich zu einmal Geimpften, die sogenannten Impfdurchbrüche, aufgetreten sind. Darauf deuten Ergebnisse der gut untersuchten Kohorte der Isländer hin. Wegen der Genkartierung waren dort viele sonst unbekannte Confounder bereits vor der Impfung bekannt, die in den üblichen Beobachtungsstudien zur Impfwirkung fehlen, wie insbesondere die Lebensumstände (22).
Die üblichen Tests zum Virusnachweis erfassen die Oberflächenantigene nur grob und sind nicht in der Lage, kleinere Mutationen zu erkennen, die möglicherweise für die Virulenz und Infektiosität relevant sind. Deswegen sind alle diese Veränderungen in der Pandemie mit Routineuntersuchungen nicht erfasst worden.
Wie erwähnt, hat man gegen Ende einer Infektion mit Corona- oder Influenzaviren bereits mehrere verschiedene Varianten im Blut (23). Bereits Ende 2020 wurden weltweit mehr als 300.000 Virusvarianten von SARS-CoV-2 im Vergleich zum Referenzgenom in Wuhan beschrieben (23). Es ist ein standardisiertes Verfahren in der Mikrobiologie, einen Infektionsweg mit der genauen genetischen Analyse der Erreger zu verfolgen (Fingerprint Methode, Phylogenetische Analyse).
Unsere Hypothese zum steilen Peak in Bergamo
Zurück nach Bergamo: Die zahlreichen und raschen Mutationen legen eine mögliche Erklärung des Bergamo-Peaks nahe. Unsere Hypothese dazu fußt im Wesentlichen auf der bisher von den Hygienikern wenig beachteten Tatsache, dass die Ausbreitung der Infektion durch Abatmung von Viren, insbesondere durch Superspreader, erfolgt. Das ist bisher in den Leitlinien, auch denen der WHO, nicht berücksichtigt (24).
Es hat sich gezeigt, dass die Letalitätsrate nach dem Ausbruch in Wuhan insgesamt relativ schnell abnahm (25). Je nach Berechnungsart und Region lag die IFR weltweit Ende 2020 bei etwas unter 0,2% (26). Betrachtet man die Todesfallrate bestimmter Gruppen, dann liegt diese natürlich höher, so z.B. in Altenheimen oder bei Vorerkrankungen. Es gibt dazu eine gute Analyse aus Österreich (27).
Trotz der anfangs regional auftretenden erhöhten Zahl an Todesfällen sind diese wegen ihrer geringen Gesamtzahl in den statistischen Letalitätsraten der Länder nicht zu erkennen. Die üblichen Schwankungen der Gesamtmortalität im Verlauf der letzten 10 Jahre sind deutlich höher.
In Abb. 5 haben wir versucht, unsere Hypothese zu den regional sehr hohen, aber rasch abfallenden Todesraten unter Berücksichtigung des Mutationsverhaltens grafisch darzustellen.

Abb. 5: Hypothetischer Verlauf der wöchentlichen Mortalität am Beginn der Coronapandemie mit dem neuen Virus aus Wuhan (Wildtyp). Die Mutationsschritte sind angedeutet mit den Strichen. Die Viren mit hoher Pathogenität sind schwarz markiert.
Durch weitere Mutationen, die sich von der ursprünglichen Variante immer weiter entfernten, ging in der Pandemie die Letalität rasch zurück. Menschen, die in bestimmten Regionen bzw. Clustern früh Kontakt zum Wildtyp hatten, zeigen eine noch relative hohe Letalität. (1. Mutation in Abb. 5). Das kann in der Lombardei der Fall gewesen sein (28).
Unter Berücksichtigung unserer Hypothesen überrascht es nicht, dass der Peak nur in einigen Regionen auftrat und nicht überall in Europa. Endemien sowie Pandemien verlaufen zu Beginn immer clusterförmig, denn es hängt davon ab, wie die gefährliche Variante sich zufällig verteilt. Zu Beginn der Coronapandemie waren - vermutlich durch eingereiste Touristen aus Wuhan - die Ausbruchsstellen in Ischgl (Apres-Ski-Partys) und in Heinsberg (Karnevalssitzung) ein gutes Beispiel dafür (29, 30). Hier kam es zwar zu clusterförmigen Infektionen, jedoch kaum zu erhöhten Todesfällen wie in der Region Bergamo. Große Säle haben oft höhere Decken, so dass die abgeatmeten Virenwolken stark verdünnt werden. Zudem waren hier bevorzugt jüngere Menschen infiziert.
Im Wuhancluster gab es anfangs eine hohe Letalität. Im Gefolge der Virusübertragungen mit Mutationen nahm diese mehr oder weniger kontinuierlich ab. Sicher haben sich auch viele jüngere Menschen infiziert und das leicht veränderte Virus weitergegeben. Wir wissen heute, dass man dazu nicht einmal Symptome gehabt haben muss. Da sich das Virus ganz vorwiegend durch Abatmung von sehr kleinen Partikeln (ähnlich wie Zigarettenrauch) weiterverbreitet (31, 32), genügen wenige Veranstaltungen in Innenräumen für endemische Ausbrüche. Dazu kommt die Erkenntnis, verstärkt durch Forschung in der Pandemie, dass für die schnelle Verbreitung von Viren durch Abatmung relativ wenige Superspreader verantwortlich sind (33). Manche der Superspreader sind dabei oft nur wenig oder gar nicht erkrankt (34). An der Außenluft nimmt die Konzentration der abgeatmeten Viren durch die Verdünnung durch Verwirbelung so schnell ab, dass es praktisch keine Ansteckung gibt (35).
Da die abgeatmeten Viren in der Raumluft über Stunden schweben, können sie nur durch Lüftung oder Luftreiniger entfernt werden. Die Infektiosität nimmt schneller ab, denn die Aerosolpartikel mit den Viren sind im Mittel nur etwa 60min infektiös (37). Man kann sich also auch in einem menschenleeren, schlecht gelüfteten Raum anstecken, wenn dieser vorher durch einen oder mehrere Superspreader gefüllt wurde, wie z. B. auf einer Toilette (35).
Was heißt das für Bergamo? Dass die kleinen Kirchen in den Bergdörfern im Bezirk Bergamo realistische Ansteckungsorte gewesen sein könnten. Viele kleinere Kirchen haben keine hohen Räume, so dass das Virus dort alle Besucher erreichen konnte. Zudem sind viele, noch mobile Ältere beim Gottesdienst und verbleiben dort eine längere Zeit. Zusätzlich wird in Gottesdiensten gemeinsam gesungen, was die Virusabatmung enorm erhöht. Bis auf das 70-fache wird in der Literatur angegeben (37). Zusätzlich gibt es in Altenheimen oft schlecht gelüftete Gemeinschaftsräume, in denen die älteren Bewohner hohe Dosen an Viren eingeatmet haben könnten. Ein Besuchsverbot hilft dann nicht, wenn das Virus einmal eingeschleppt wurde, was auch durch nicht erkranktes, aber Viren abatmendes, Personal geschehen sein kann.
Diese Faktoren könnten für eine höhere Anfangsdosis bei der Infektion gesorgt haben, wodurch sich die Letalität deutlich erhöht: Unser Immunsystem hat dann nicht genug Zeit, seine Abwehrfunktionen zu mobilisieren. Für diese Hypothese spricht auch, dass während des Letalitätspeaks im Raum Bergamo allein 25 Priester gestorben sein sollen. (38).
Ein weiterer Hinweis könnte die Tatsache sein, dass am 19. Feb. 2020 ein Fußballspiel (Atalanta Bergamo – FC Valencia) im 50km entfernten Mailand stattfand, das Bergamo mit 4:1 gewann. Anschließend kam es zu ausgedehnten Feiern des Sieges der heimischen Mannschaft in Gaststätten, Bars und auch Privathäusern. Eine Ansteckung im Stadion auf den Tribünen ist nicht wahrscheinlich, da die Konzentration der abgeatmeten Viren an der Außenluft rasch verdünnt wird (35). Deswegen gab es vermutlich auch keinen Peak in Valencia, da die spanischen Fans an den Siegesfeiern vermutlich nur selten beteiligt waren.
Es ist nicht nur theoretisch möglich, sondern es gibt auch Hinweise darauf, dass die Entstehung von Superspreadern von der Mutation beeinflusst wird (39). Weiterhin wäre auch möglich, dass der Wildtyp aus Wuhan durch seine Beeinflussung von Lungenzellen (Pneumozyten-Typ 2), welche den für die Abatmung der Viren entscheidenden Surfactant produzieren, mehr Superspreader erzeugte als seine späteren Mutationen (40).
Unsere Hypothese zum steilen Abfall des Peaks in Bergamo
Die Tatsache, dass der steile Letalitätsanstieg innerhalb von 2-3 Wochen dann genauso rasch abfällt, erscheint auf den ersten Blick überraschend. Das ist aber leicht zu erklären, wenn der Ausbreitungsmodus durch Abatmung infektiöser Viren betrachtet wird, und man sich dazu von einer vorherrschenden Annahme löst: Nämlich dass die Übertragung, vorwiegend durch Husten, Niesen und Sprechen geschieht. Obwohl diese Annahme seit ca. 2014 durch Aerosolmessungen und Tierversuche für Influenzaviren widerlegt ist, steht sie weiterhin unverändert in den Leitlinien (41, 42). Bakterien, die z. B. Pertussis oder Tuberkulose auslösen, werden so übertragen, was Luis Pasteur schon vor 1900 nachgewiesen hatte. Aber: Bakterien können nicht wie Viren abgeatmet werden. Bakterien passen nicht in die, in den kleinen Bronchien erzeugten, Aerosoltröpfchen mit ca. 1µm Größe hinein. Diese Tröpfchen schrumpfen in Sekundenbruchteilen durch Trocknung an der Außenluft auf ca. 0,3µm. Durch Husten übertragene bakterielle Infektionserkrankungen zeigen deswegen immer nur ein endemisches und nur ganz selten ein epidemisches Verhalten, wenn man längere Zeiträume betrachtet, wie z. B. beim Keuchhusten. Da die Viren bevorzugt abgeatmet werden und sich wie Zigarettenrauch im Raum rasch verteilen, hilft auch die Abstandsregel nicht. Sie erzeugt nur falsche Sicherheit.
Wenn Superspreader in kleinen Clustern wie z.B. bei Veranstaltungen in schlecht gelüfteten Räumen, zu Hause oder in kleinen Kirchen Viren abatmen, entsteht eine lokale Herdenimmunität für den aktuellen Virus (hier SARS-CoV-2 Wildtyp) der Überlebenden, da praktisch alle im Raum das Virus eingeatmet haben. So kommt es zu einer breiten Durchseuchung, wobei nicht alle krank werden müssen. Die derart erworbene Herdenimmunität hält dann für den Pandemie-Virus so lange an, bis sich neue Virustypen gebildet haben, die das Immunsystem nicht mehr sofort abwehren kann und eine neue Infektion ermöglichen. Das ist nicht nur bei der Coronapandemie so gewesen, sondern ist auch von den Influenzapandemien gut bekannt. Nicht selten erlebt man eine Influenzainfektion im Herbst und im nächsten Frühjahr bei den selben Patienten.
Ähnliche Peaks gab es auch schon bei anderen Pandemien, z.B. der Spanischen Grippe 1918/19. Abb. 6 zeigt dies für ein größeres Cluster an Beispiel der Stadt New York (43). Hier ist die Basis bzw. der Peak etwas breiter als in Bergamo, was sich leicht durch die viel größere Anzahl an Menschen erklären lässt. New York hatte damals schon ein größeres U-Bahn-Netz, so dass vermutlich dieses der Hauptansteckungsort gewesen sein dürfte, denn Lüftungen in U-Bahnen gab es erst später. Die damaligen Stoffmasken haben zwar die durch Husten erzeugten Tröpfchen zurückgehalten, jedoch nicht die Viren. Wir haben dazu eigene Untersuchungen durchgeführt, wobei wir die Dichtigkeit verschiedener Masken und Maskenmaterialien mit radioaktiv markierten kleinen Partikeln um 0,5µm gemessen haben (44, 45).

Abb. 6: Verlauf der täglichen Todesfälle durch die spanische Grippe 1918 in New York.
Ein wichtiger Punkt wird bei Betrachtung der Virusletalität oft vergessen. Neben der Virulenz spielt die Anfangsdosis bzw. die Virenanzahl/Zeit eine dominante Rolle für die Zahl der schweren Fälle und die Letalität. Ist die inhalierte Dosis am ersten Tag sehr hoch, z. B. 50.000 Viren, so läuft die Virusvermehrung schneller ab als die Aktivierung des Immunsystems. Damit fehlt die adäquate Abwehr und der Patient hat einen schwereren Verlauf und ein erhöhtes Letalitätsrisiko. Das ist aus Tierversuchen - z. B. zur Dosisfindung bei Virusinoculationen - gut bekannt. Daher solle die Reduktion der Ansteckungsdosen bei der Hygienebetrachtung im Vordergrund stehen (46).
Also: Wenn wir annehmen, dass es in einigen Regionen wie in Bergamo, Madrid oder Stockholm (Abb. 3) einen frühen Kontakt mit dem Wildtyp gegeben hat, so kann der jeweilige Peak wie eben erläutert erklärt werden. Später nahm die Virulenz, also die krankmachende Wirkung rasch ab, so dass die kleineren Peaks in den wöchentlichen Todesraten verschwanden. Im Bezirk Bergamo ist ein früher Kontakt mit dem Wildtyp aus Wuhan recht wahrscheinlich, denn es gibt dort in der Textilindustrie viele chinesische Arbeiter, die oft zwischen China und Italien hin und her reisen (47). Auch in den anderen Regionen in Europa mit Letalitätspeaks gibt es Industriebereiche mit chinesischen Arbeitsmigranten, die in eigenen Wohnvierteln untergebracht sind (48, 49).
Gehäufte Todesfälle in der Region führen natürlich sofort zu Reaktionen der dortigen Bevölkerung (50). Im Vordergrund steht als erste Maßnahme in der Regel die Kontaktreduzierung. Dadurch tauchen erst einmal keine oder nur wenig neue Fälle mehr auf. Das könnte zusätzlich den raschen Abbruch des Peaks erklären. Im Gefolge der weiteren Mutationen nimmt die Letalität dann weiter ab, so dass noch vorkommende kleine Spitzen im Rauschen der allgemeinen Letalitätskurve untergehen (Abb. 5).
Einen zusätzlichen Effekt auf den weiteren Verlauf der Coronapandemie dürften die Mitte März einsetzenden Lockdown-Maßnahmen in Europa bzw. weltweit gehabt haben. Der Letalitätspeak in verschiedenen Regionen Europas um die 12. bis 13. Kalenderwoche (Abb. 3) wurde durch die Lockdowns jedoch nicht beeinflusst, denn die Inkubationszeit des neuen Coronavirus liegt zwischen ein bis zwei Wochen. Bis dann der Tod bei schweren Verläufen eintritt, vergehen mindestens noch einmal 1-2 Wochen. Demnach hat die Masse der Infektionen bzw. Todesfälle, vor den Lockdowns stattgefunden. Allerdings hat der erste Lockdown mit der Reisereduzierung sicher erst einmal den weiteren Kontakt zu dem virulenten Wildtyp gebremst.
Überlastung der Intensivstationen als Erklärung des Peaks?
Eine weitere, mögliche Hypothese für die Mortalitätspeaks wäre die regionale Überlastung der Intensivstationen. Obwohl die reiche Lombardei über relativ viele und gut ausgerüstete Krankenhäuser verfügt, ist eine Überlastung im März 2020 anzunehmen (51). Das gilt auch für die Regionen in Europa, in denen zu Beginn der Pandemie Cluster mit hoher Letalität auftraten.
Diese Hypothese ist aber wenig wahrscheinlich. Es spricht nämlich vieles für einen Anstieg der Letalität auf den Intensivstationen, wenn gemäß den nationalen und internationalen Leitlinien bei einer Covid-19-Pneumonie intubiert und beatmet wird (41). Das hängt mit der Überwertung der Hypoxämie in der Viruspneumonie zusammen (52, 53). Patientenkohorten mit Covid-19, die auf Intensivstation gemäß den Leitlinien mit der Folge einer frühen Intubation auch schon bei milder Hypoxämie beatmet wurden, zeigten eine Letalität von 40 – 60% (54, 55). Wird hingegen erst bei deutlichem Absinken des Sauerstoffgehaltes beatmet, so beträgt die Letalität unter 10% (56).
Eine knappe Zahl an Intensivbetten hat demnach die Letalität eher vermindert als erhöht. Dafür spricht auch die Tatsache, dass in Deutschland, das mit Abstand über die meisten Intensivbetten pro Einwohner im Vergleich zu den anderen europäischen Ländern verfügt (57), die Todesrate während der Pandemie am Ende höher war (58).
Weitere mögliche Hypothesen für den Letalitätspeak
Andere Ursachen für den Peak wurden international diskutiert. Es war aufgefallen, dass es in Großbritannien und anderen Ländern in etwa zeitgleiche Peaks an Bestellungen von Midazolam und Covid-19-Todesfällen gab (59). Das überrascht nicht, denn Midazolam ist ein kurzwirksames Benzodiazepin, das sehr häufig auf den Intensivstationen zur Einleitung und öfters auch zur Aufrechterhaltung der invasiven Beatmung eingesetzt wird. Es spiegelt damit die Belastung der Intensivstationen wieder. Eine weitere theoretische Möglichkeit wäre die Kontamination mit Giften, die mit den Corona-Teststäbchen verabreicht wurden. Das erscheint unwahrscheinlich, denn es passierte an voneinander entfernten Orten gleichzeitig. Zudem müsste es ein sehr starkes Gift sein, wegen der minimal applizierten Menge. Außerdem würden die bekannten starken Gifte zu gänzlich anderen Krankheitsbildern und nicht zu einer fieberhaften Pneumonie führen.
Haben die Peaks politische Entscheidungen beeinflusst?
Der Verlauf der ersten Wochen der Pandemie mit der anfangs hohen Letalität in Wuhan und den regionalen Clustern in Europa hat die politischen Entscheidungen damals stark beeinflusst. Zudem gibt es Hinweise darauf, dass den Regierungen von den Geheimdiensten Informationen über die Entwicklung in Wuhan, einschließlich des starken Verdachts auf einen Laborunfall, übermittelt wurden (12). Damit erklärt sich auch der auf den ersten Blick unbegründet harte Lockdown in vielen Ländern.
Da anfangs vieles unklar war, sind in dieser Zeit die meisten politischen Entscheidungen verstehbar. Für die Schulschließungen gab es aber bereits im zweiten Halbjahr 2020 keine wissenschaftliche Evidenz; Mitte 2020 war der Rückgang der Letalität deutlich erkennbar. Dieses Phänomen ist nicht neu und in der Pandemie-Forschung seit Jahrzehnten bekannt. Natürlich geschah früher die Ausbreitung derartiger Viren deutlich langsamer, durch die reduzierte Mobilität und andere Reisebedingungen. Damit liefen auch die Variationsentwicklung und der Rückgang der Letalität deutlich langsamer ab. Insofern hat sich diese Pandemie schneller verbreitet als alle anderen, was auch die Steilheit bzw. kurze Dauer der Peaks mit erklärt.
Ein Fazit und Forschungsempfehlungen für künftige Pandemien mit respiratorischen Erkrankungen
Unsere Hypothese zur erhöhten Letalität in Bergamo, der „Schatten von Wuhan“, ist aus einem methodischen Grund empirisch schlecht nachzuweisen: Es dürfte kaum möglich sein, Kontaktverläufe zum Wildtyp zu rekonstruieren. Allerdings macht es Sinn zur Vorbereitung für die nächste Pandemie über das Land verteilte zwei bis vier permanent erfasste Kohorten einzurichten (41), die dann näher untersucht werden. Folgende Empfehlungen ergeben sich aus den diskutierten Hypothesen:
- Routinemäßige Erfassung von Änderungen der persönlichen Daten und Erkrankungen, auch außerhalb einer Pandemie
- Messung der abgeatmeten Partikel bei Infizierten
- Genetische Analyse der abgeatmeten Viren in einer Untergruppe
- Bestimmung aller Virentypen, an denen Infizierte erkrankt sind. Es gab in der Coronapandemie, insbesondere nach 2021, viele Co-Infektionen mit anderen Viren, meist Influenza, die mitunter hauptverantwortlich für die Erkrankung waren, aber fälschlicherweise dem Pandemievirus zugeordnet wurden (60, 61).
- Asservierung von Blutproben von Infizierten aus der Kohorte, um später weitere Analysen durchführen zu können (z. B. Mutationen, Kontaktverfolgung)
Wir bedanken uns sehr herzlich für die Diskussionsbeiträge von:
Prof. Dr. Günter Theißen, Prof. Dr. Detlev H. Krüger; Prof. Dr. Andreas Radbruch, Prof: Dr. Klaus Stöhr, PD Dr. Stefan Pilz und Tom Lausen
Literatur
(alle angegebenen Webseiten waren am Erscheinungsdatum noch verfügbar)
1. China ergreift drastische Massnahmen im Einsatz gegen das Coronavirus | NZZ
2. Coronavirus: In Wuhan wird ein Spital in acht Tagen gebaut
3. Coronavirus: Passanten trauen sich nicht, sich dem Toten zu nähern - WELT
5. Shi H, Han X, Jiang N et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020 Apr;20(4):425-434. doi: 10.1016/S1473-3099(20)30086-4
6. https://www.youtube.com/watch?v=QSZp_rdGp04
8. Writing Committee of the Second World Health Organization Consultation on Clinical Aspects of Human Infection with Avian Influenza A (H5N1) Virus; Abdel-Ghafar AN, Chotpitayasunondh T, Gao Z et al. Update on avian influenza A (H5N1) virus infection in humans. N Engl J Med. 2008 Jan 17;358(3):261-73. doi: 10.1056/NEJMra0707279.
9. Huang Y, Yang J, Chen Jet al. Association between ambient temperature and age-specific mortality from the elderly: Epidemiological evidence from the Chinese prefecture with most serious aging. Environ Res. 2022 Aug;211:113103. doi: 10.1016/j.envres.2022.113103
10. Günter Theißen Das Virus – auf der Suche nach dem Ursprung von Covid-19. Westend Frankfurt 2022
12. https://www.tagesschau.de/inland/bnd-coronavirus-ursprung-100.html
13. Kam das Virus aus dem Labor? ‒ Vortrag von PD Dr. Andreas Edmüller bei SitP München - YouTube
14. Oversight of Gain-of-Function Research with Pathogens: Issues for Congress https://www.congress.gov/crs-product/R47114
15. Gain-of-function-Forschung – Wikipedia
16. Greenberg SB. Update on Human Rhinovirus and Coronavirus Infections. Semin Respir Crit Care Med. 2016 Aug;37(4):555-71. doi: 10.1055/s-0036-1584797.
17. Starr TN, Greaney AJ, Hilton SK et al. Deep Mutational Scanning of SARSSARS-CoV-2 Receptor Binding Domain Reveals Constraints on Folding and ACE2 Binding. Cell. 2020 Sep 3;182(5):1295-1310.e20. doi: 10.1016/j.cell.2020.08.012.
18. Spike-Glykoprotein von SARS-CoV-2 – Wikipedia
19. Coronavirus: Irreführendes Youtube-Video verbreitet sich über Whatsapp - correctiv.org
21. Gina Kolata, Influenza – Die Jagd nach dem Virus. Fischer, Frankfurt 2003
22. Eythorsson E, Runolfsdottir HL, Ingvarsson RF, Sigurdsson MI, Palsson R. Rate of SARS-CoV-2 Reinfection During an Omicron Wave in Iceland. JAMA Netw Open. 2022 Aug 1;5(8):e2225320. doi: 10.1001/jamanetworkopen.2022.25320.
23. Mercatelli D, Giorgi FM. Geographic and Genomic Distribution of SARS-CoV-2 Mutations. Front Microbiol. 2020 Jul 22;11:1800. doi: 10.3389/fmicb.2020.01800.
24. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/advice-for-public
25. Ioannidis JPA.Eur J Epidemiol. 2021 Jun;36(6):581-588. doi: 10.1007/s10654-021-00787 Review
26. Ioannidis JPA. Global perspective of COVID-19 epidemiology for a full-cycle pandemic. Eur J Clin Invest. 2020 Dec;50(12):e13423. doi: 10.1111/eci.13423
27. Riedmann U, Chalupka A, Richter L et al. COVID-19 case fatality rate and infection fatality rate from 2020 to 2023: Nationwide analysis in Austria. J Infect Public Health. 2025 Apr;18(4):102698. doi: 10.1016/j.jiph.2025.102698.
28. Alteri C, Cento V, Piralla A et al. Genomic epidemiology of SARS-CoV-2 reveals multiple lineages and early spread of SARS-CoV-2 infections in Lombardy, Italy. Nat Commun. 2021 Jan 19;12(1):434. doi: 10.1038/s41467-020-20688-x.
29. https://de.wikipedia.org/wiki/COVID-19-Pandemie_in_Ischg
30. Korencak M, Sivalingam S, Sahu A et al. Reconstruction of the origin of the first major SARS-CoV-2 outbreak in Germany. Comput Struct Biotechnol J. 2022;20:2292-2296. doi: 10.1016/j.csbj.2022.05.011
31. Scheuch G. Breathing Is Enough: For the Spread of Influenza Virus and SARS-CoV-2 by Breathing Only. J Aerosol Med Pulm Drug Deliv. 2020 Aug;33(4):230-234. doi: 10.1089/jamp.2020.1616.
32. Position paper on aerosols and SARS-CoV-2
33. Majra D, Benson J, Pitts J et al. SARS-CoV-2 (COVID-19) superspreader events. J Infect. 2021 Jan;82(1):36-40. doi: 10.1016/j.jinf.2020.11.021
34. Sosnowski TR. Inhaled aerosols: Their role in COVID-19 transmission, including biophysical interactions in the lungs. Curr Opin Colloid Interface Sci. 2021 Aug;54:101451. doi: 10.1016/j.cocis.2021.101451
35. https://www.sokrates-rationalisten-forum.de/lufthygiene-check
36. van Doremalen N, Bushmaker T, Morris DH ert al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. N Engl J Med. 2020 Apr 16;382(16):1564-1567. doi: 10.1056/NEJMc2004973
37. Ueda M, Hayashi K, Nishiura H. Identifying High-Risk Events for COVID-19 Transmission: Estimating the Risk of Clustering Using Nationwide Data. Viruses. 2023 Feb 6;15(2):456. doi: 10.3390/v15020456.
39. Yousefbeigi S, Marsusi F. Structural insights into ACE2 interactions and immune activation of SARS-CoV-2 and its variants: an in-silico study. J Biomol Struct Dyn. 2025 Feb;43(2):665-678. doi: 10.1080/07391102.2023.2283158.
40. Krygier A, Szmajda-Krygier D, Świechowski R et al. Molecular Pathogenesis of Fibrosis, Thrombosis and Surfactant Dysfunction in the Lungs of Severe COVID-19 Patients. Biomolecules. 2022 Dec 10;12(12):1845. doi: 10.3390/biom12121845.
41. Clinical management of COVID-19: Living guideline, 18 August 2023
43. What New York Looked Like During the 1918 Flu Pandemic - The New York Times
44. Dellweg D, Haidl P, Kerl J et al Bench testing of noninvasive ventilation masks with viral filters for the protection from inhalation of infectious respirable particles. J Occup Environ Hyg. 2021 Mar;18(3):118-127. doi: 10.1080/15459624.2020.1862417
45. Held A, Dellweg D, Köhler D et al. Interdisziplinäre Perspektiven zur Bedeutung der Aerosolübertragung für das Infektionsgeschehen von SARS-CoV-2 [Interdisciplinary Perspectives on the Role of Aerosol Transmission in SARS-CoV-2 Infections]. Gesundheitswesen. 2022 Jul;84(7):566-574. German. doi: 10.1055/a-1808-0086.
46. https://www.sokrates-rationalisten-forum.de/lehren-aus-der-pandemie
48. https://www.nzz.ch/gesellschaft/wieso-italien-dem-virus-erlag-ld.1562191
49. https://www.deutschlandfunk.de/textilproduktion-chinesische-wanderarbeiter-in-der-toskana-100.html
53. Köhler D, Voshaar T, Stais P, et al. Hypoxic, anemic and cardiac hypoxemia: When does tissue hypoxia begin? Dtsch Med Wochenschr. 2023 Apr;148(8):475-482. doi: 10.1055/a-2007-5450
54. Yang X, Yu Y, Xu J, Shu H et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020 May;8(5):475-481. doi: 10.1016/S2213-2600(20)30079-5
55. Roedl K, Jarczak D, Thasler L et al. Mechanical ventilation and mortality among 223 critically ill patients with coronavirus disease 2019: A multicentric study in Germany. Aust Crit Care. 2021 Mar;34(2):167-175. doi: 10.1016/j.aucc.2020.10.009.
56. Voshaar T, Stais P, Köhler D, Dellweg D. Conservative management of COVID-19 associated hypoxaemia. ERJ Open Res. 2021 Mar 15;7(1):00026-2021. doi: 10.1183/23120541.00026-2021.
57. Schweden 2021: Nur halb so viele Intensivbetten* – infosperber
60. SARS-CoV-2 co-infection with influenza viruses, respiratory syncytial virus, or adenoviruses
Hashemi SA, Safamanesh S, Ghasemzadeh-Moghaddam H et al. A. High prevalence of SARS-CoV- 2 and influenza A virus (H1N1) coinfection in dead patients in Northeastern Iran. J Med Virol. 2021 Feb;93(2):1008-1012. doi: 10.1002/jmv.26364












